Periodische Eigenschaften
Die Genialität der Anordnung der Elemente im PSE zeigt sich, wenn man deren Eigenschaften genauer unter die Lupe nimmt und miteinander vergleicht.
Zu den Wesentlichen dabei relevanten Größen zählen die Ionisierungsenergie, die Elektronenaffinität, die Elektronegativität sowie die Atom- und Ionenradien.
Die nachfolgenden Grafiken zeigen den Anfangsteil des PSE – so, dass man bildhaft eine Einsicht darin bekommt, was man unter der so oft erwähnten „Periodizität“ überhaupt versteht. Für genauere Werte der einzelnen Eigenschaften sind Literatur oder spezialisiertere Websites zu konsultieren (siehe Weiterführende Links).
Insbesondere erkennt man schnell die Periodizität der Eigenschaften zwischen den jeweiligen Hauptgruppen und Nebengruppen.
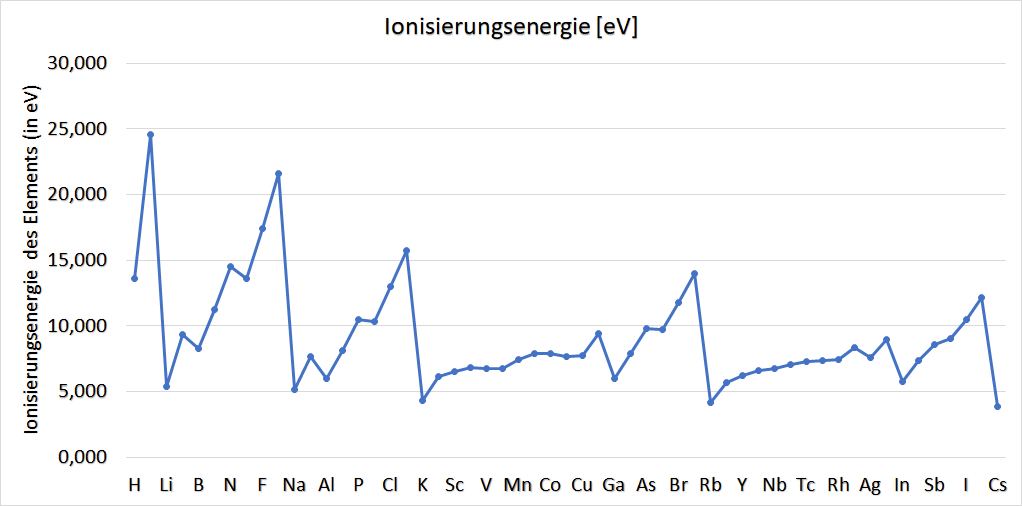
Zur Ionisierungsenergie:
Die Energie, die aufgewandt werden muss, um aus einem Atom ein Elektron abzuspalten, heißt Ionisierungsenergie.
Nach diesem Prozess bleibt ein Ion (genauer: ein Kation, dies ist ein positiv geladenes Ion) zurück.
Da das Atom bei der Ionisierung Energie aufnimmt, ist diese Energie positiv.
Für chemische Betrachtungen ist die Ionisierungsenergie eines Atoms weniger interessant – man betrachtet direkt die molare Ionisierungsenergie, also jene Energie, die man aufwenden muss, um ein Mol eines Stoffes zu ionisieren. Im physikalischen Kontext gibt man diese Energien meistens in der Einheit Elektronenvolt (eV) an.
In der Grafik unterhalb sind die ersten Ionisierungsenergien aufgetragen. Würde man weiter gehen und das dabei erhaltene Kation nochmals ionisieren, spräche man von der zweiten Ionisierungsenergie usw., wobei diese Energie stetig zunimmt.
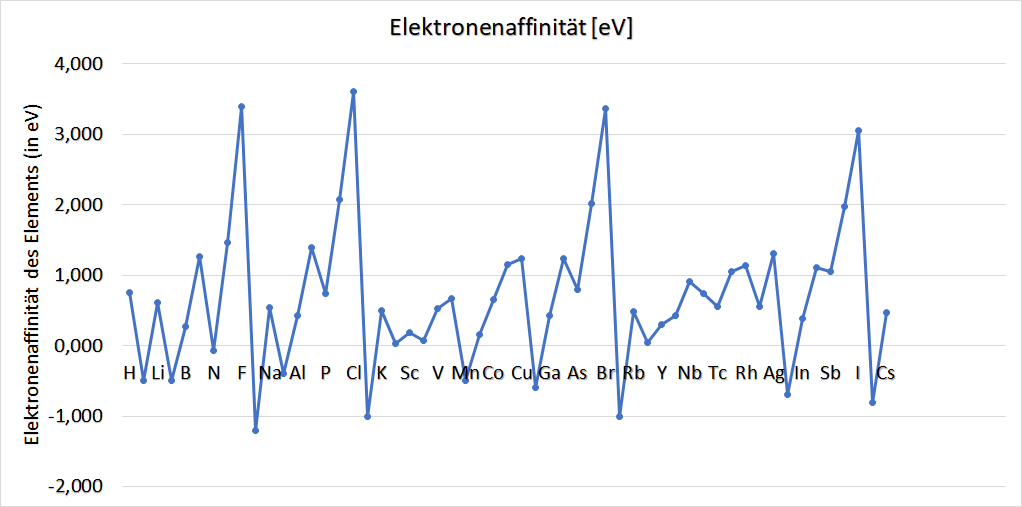
Zur Elektronenaffinität:
Die Aufnahme von Elektronen erfolgt unter Abgabe von Energie. Entweder wird ein Kation dadurch (weniger) positiv geladen, und die bei der Elektronenaufnahme freiwerdende Energie entspricht der jeweiligen Ionisierungsenergie, oder aber es bildet sich aus einem neutral geladenen Element durch die Aufnahme eines zusätzlichen Elektrons ein negativ geladenes Teilchen aus, ein sogenanntes Anion. Qualitativ sagt man oft, dass die Elektronenaffinität die „Tendenz“ eines Atoms ist, Elektronen an sich zu binden (also aufzunehmen).
Die Elektronenaffinität ist damit jene Energie, die frei wird, wenn ein Atom ein Elektron aufnimmt.
Alternativ: Die Elektronenaffinität entspricht der negativen Ionisierungsenergie des bei der Aufnahme des Elektrons entstehenden Anions.
Die Angabe dieser Energie erfolgt analog zur Ionisierungsenergie zumeist in Elektronenvolt.
Zur Elektronegativität:
Die Elektronegativität ist jene Größe, die angibt, wie stark die Elektronen, die in einer Atombindung (elektronische Bindung zwischen 2 Atomen, bei der Elektronen quasi „aufgeteilt“ werden) in einem Molekül vorkommen, von dem betrachteten Atom angezogen werden.
Sie hat keine Maßeinheit, ist also rein als Zahlenwert zu verstehen und dient eben zur Vergleichbarkeit der Eigenschaft, welches Element wie stark in einer Bindung die Elektronen an sich heranzieht (in anderen Worten: wie stark ein Bindungspartner in der Atombindung nach den Elektronen „geiert“).
Diese Größe ist unter anderem deswegen hochrelevant, weil sie durch diesen Elektronenverschub (und den damit einhergehenden Ladungsverschub) erklärt, warum gewisse Moleküle Dipole (einen Pluspol und einen Minuspol bzgl. der Ladung) ausbilden, obwohl sie eigentlich aus zwei Atomen bestehen, und nicht aus zwei Ionen.
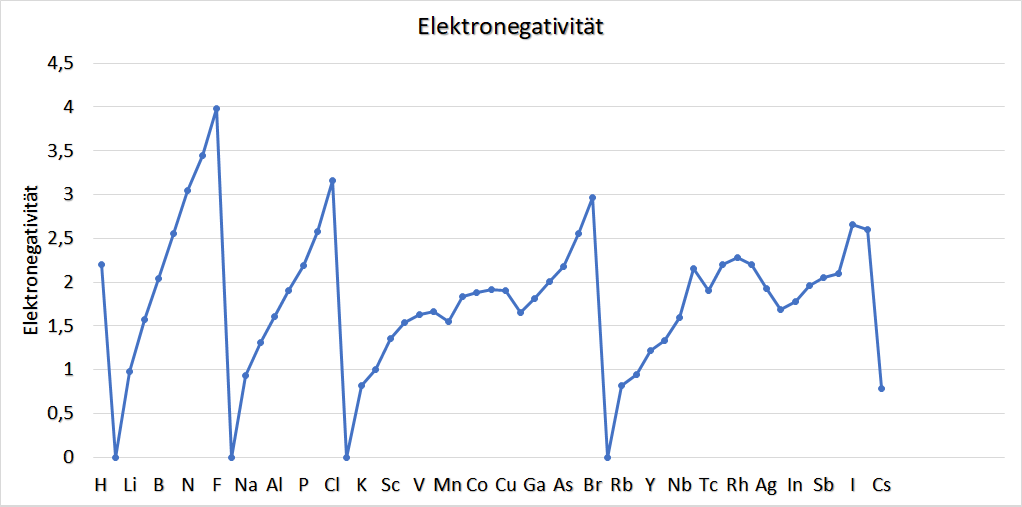
(Anm.: Die Edelgase werden bei der Betrachtung der Elektronegativität herausgenommen, da diese [quasi] als unreaktiv angesehen werden)
Zu den Atom- und Ionenradien:
Unter dem Atomradius versteht man den kovalenten Radius, der sich aus der Hälfte des Abstandes zwischen zwei gleichen Atomkernen ergibt.
Der gesamte Abstand zwischen zwei miteinander verbundenen Kernen in einer chemischen Bindung wird allgemein als Bindungslänge bezeichnet.
Der metallische Radius ist die Hälfte jenes Abstandes, der im Metallgitter zwischen zwei Atomkernen vorliegt.
Beide Radien werden oftmals unter dem Oberbegriff „Bindungsradius“ zusammengefasst.
Die Atomradien liegen größenordnungstechnisch im Bereich eines Zentel Nanometers.
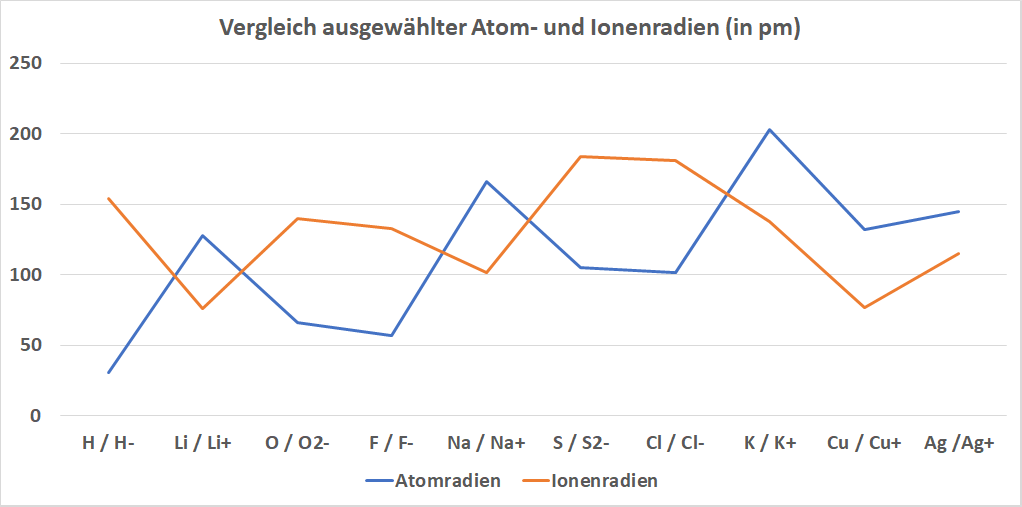
Die Angabe erfolgt oft in der Einheit Ångström, wobei 1 Ångström = 100 pm sind. (Die Grafiken unterhalb sind in pm angegeben).
Bezüglich des Atomradius lässt sich folgende Querverbindung herstellen:
Je größer der Atomradius, desto schwächer wird die elektronische Anziehung zwischen den positiv geladenen Protonen im Kern und den Valenzelektronen.
Entsprechend sinkt mit steigendem Radius die Ionisierungsenergie, was man in der Grafik zur Ionisierungsenergie oberhalb erkennen kann.
Unter den Ionenradien versteht man im Wesentlichen das Gleiche wie unter den Atomradien, wobei hierbei Kationen bzw. Anionen betrachtet werden. Durch die jeweils unterschiedlichen Ladungsverhältnisse und die dabei auftretenden elektrostatischen Anziehungskräfte weichen die Radien aber stark von den Atomradien ab.
In der Grafik unterhalb wird der Größenunterschied einiger ausgewählter Atomradien zu ihren entsprechenden Ionenradien angeführt. Für detailliertere Darstellungen, insbesondere bezüglich der auch hier vorliegenden Periodizität der Radien, siehe: Weiterführenden Links.
Vorheriges Kapitel (Periodensystem und Atombau)
Nächstes Kapitel (Spezielle Elementtypen)