Molekülbildung
Moleküle sind Teilchen, die aus zwei oder mehreren Atomen aufgebaut sind. Das heißt, einzelne Atome verbinden sich zu einem gemeinsamen Molekül. Dabei können die Moleküle aus Atomen des gleichen Elements oder aus Atomen unterschiedlicher Elemente aufgebaut sein.
In der Natur findet man nur die wenigsten Elemente in ihrer atomaren Form. Die meisten Elemente gehen mit sich selbst oder anderen Elementen eine Verbindung ein und bilden Moleküle. Da in der Natur nichts ohne Grund geschieht, muss es für dieses Bestreben eine Ursache geben.
Systeme streben immer zwei Zuständen entgegen:
- Dem Zustand der maximalen Unordnung
- Dem Zustand des kleinsten Energieniveaus
Dieses Bestreben wird durch die Gibbs-Helmholtz-Gleichung beschrieben.
Der blaue Term beschreibt das Bestreben eines Systems, seine Unordnung zu erhöhen. Man spricht von der Entropie ΔS. Der rote Term beschreibt das Bestreben eines Systems, ein möglichst kleines Energieniveau zu erhalten. Es handelt sich um die Enthalpie ΔH.
Das Ergebnis der beiden Terme ist die freie Energie ΔG. Ist ΔG einer Reaktion negativ, wird bei dieser Energie frei. Die Reaktion läuft freiwillig ab. Man spricht von einer exergonischen Reaktion.
Umgekehrtes gilt für eine Reaktion mit einem positiven ΔG. Bei diesem Reaktionstyp muss für das Ablaufen, Energie aufgewendet werden. Die Reaktion läuft nicht freiwillig ab.
Da wie bereits erwähnt, die meisten Atome freiwillig Reaktionen zu Molekülen eingehen, muss die freie Energie dieser Reaktionen negativ sein. Nun stellt sich die Frage, welcher der beiden oder ob sogar beide Terme für dieses Ergebnis verantwortlich sind.
Überlegt man sich, was bei der Reaktion von Atomen zu Molekülen passiert, wird eines schnell klar: Die Unordnung und somit die Entropie müssen abnehmen, denn aus zwei oder mehreren Teilen wird ein Teil, was einem höher geordneten Zustand entspricht.
Dieser Effekt wird noch verstärkt, wenn aus gasförmigen Edukten, flüssige oder feste Produkte entstehen.
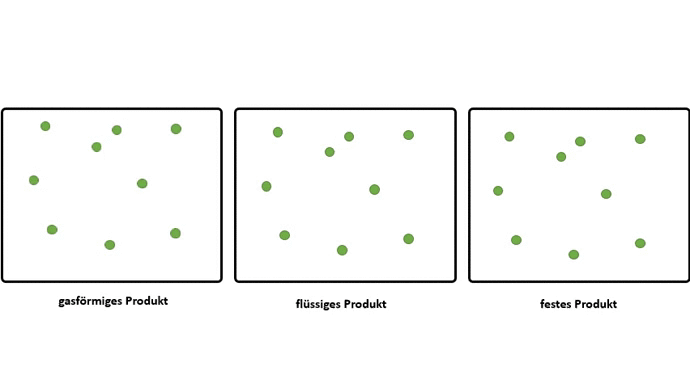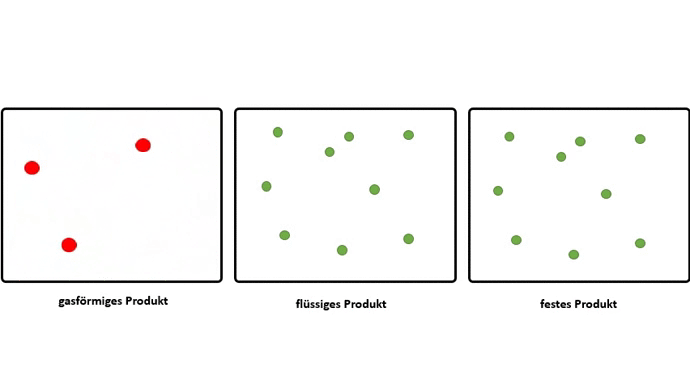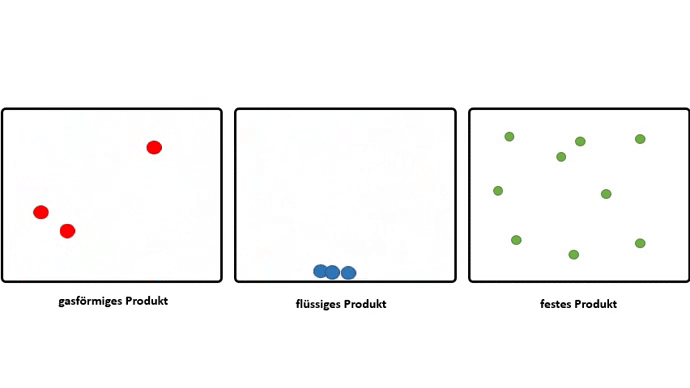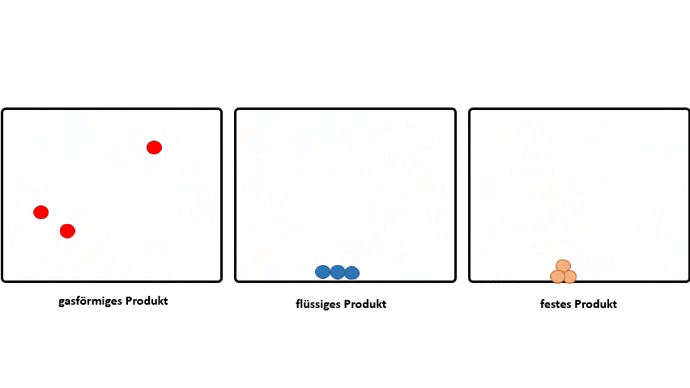
Somit muss der Grund für das Zusammenschließen von Atomen zu Molekülen, also das Bilden von chemischen Bindungen, darin liegen, dass dadurch ein niedrigeres Energieniveau erreicht wird.
Kurzgefasst: Das Ausbilden von chemischen Bindungen zwischen Atomen, sprich deren Reaktion zu Molekülen, ist energetisch günstiger, als die dadurch entstandene ungünstige Ordnung.
Achtung! Diese Betrachtung gilt nur für die Reaktion von Atomen zu Molekülen.
Daraus resultiert die Frage, aus welchem Grund die Reaktion von Atomen zu Molekülen energetisch günstig ist und welchem Ziel bzw. Muster dieser Vorgang folgt.
Zur Beantwortung dieser Frage werden zwei unterschiedliche Konzepte herangezogen: die Valenzbindungstheorie und die Molekülorbitaltheorie. Die Valenzbindungstheorie ist einfacher und anschaulicher als die MO-Theorie. Damit einhergeht jedoch, dass die VB-Theorie weniger umfassend ist. Die MO-Theorie ist allgemeiner anwendbar, dafür komplexer und mit weniger Bezug zur Struktur des Moleküls.
Valenzbindungstheorie
Die VB-Theorie basiert darauf, dass Atome der Edelgaskonfiguration entgegenstreben. Edelgaskonfiguration bedeutet, dass die äußerste Schale des Atoms vollgefüllt ist mit Elektronen. Dieser Zustand ist besonders stabil. Das ist die Ursache, warum Edelgase, die sich in diesem Zustand befinden, so reaktionsträge sind. Sie befinden sich bereits in einem energetisch sehr günstigen Zustand. Edelgase gehören zu den Elementen, die in atomarer Form vorkommen.
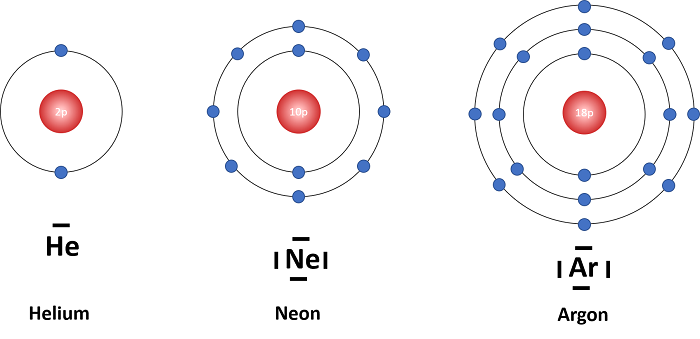
Andere Atome erreichen diesen Zustand, indem sie Elektronen mit anderen Atomen teilen. Es kommt zur Überlappung von Atomorbitalen. Diese Überlappung bewirkt eine Verschiebung der Aufenthaltswahrscheinlichkeit der Elektronen. Durch diese Ladungsverteilung kommt es zur Anziehung der Atome und somit zur Bindung zu einem Molekül. Die Verbindung zu einem Molekül ist energetisch günstiger.
Wasserstoffatome streben die Heliumkonfiguration an, also zwei Valenzelektronen. Die meisten Hauptgruppenelemente streben acht Valenzelektronen an, sprich die Konfiguration der weiteren Edelgase. Man spricht von der Oktettregel.
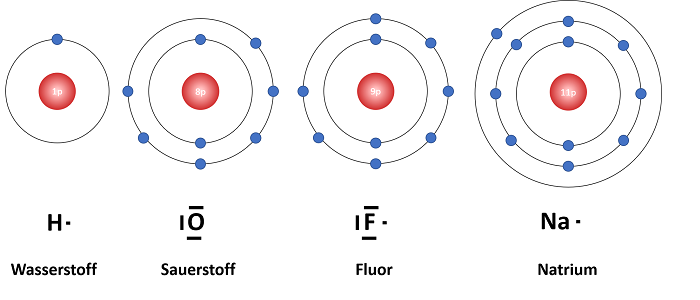
Fluor erhält die Edelgaskonfiguration am leichtesten, wenn dieses ein Elektron durch Bindung mit einem anderen Atom aufnimmt. Sauerstoff hingegen muss für die Edelgaskonfiguration zwei Elektronen aufnehmen. Das Resultat daraus ist meist eine Doppelbindung. Natrium erhält die Edelgaskonfiguration, wenn dieses ein Elektron an einen Reaktionspartner abgeben kann. Wasserstoff ist je nach Reaktionspartner in der Lage, Elektronen abzugeben oder aufzunehmen
Um das Reaktionsverhalten der Übergangsmetalle zu beschreiben, ist die VB-Theorie nicht geeignet. Dazu ist die MO-Theorie notwendig. Aus dieser geht die 18-Elektronen-Regel hervor. Diese ist in gewisser Weise für die Übergangsmetalle, was die Oktettregel für die Hauptgruppenelemente ist.
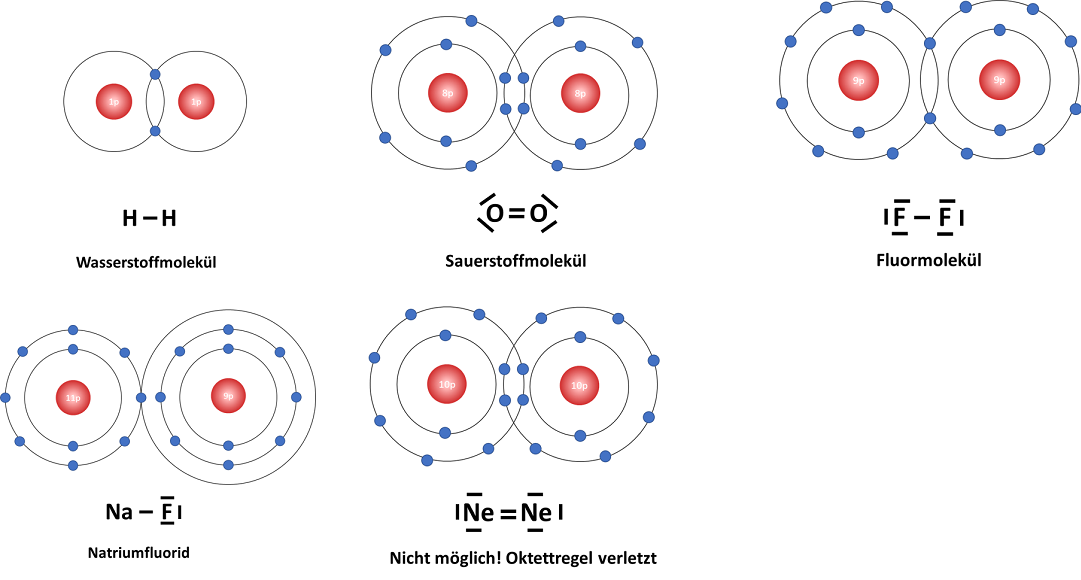
Wie in der oberen Abbildung schon angedeutet, ergibt nicht jede Kombination aus Atomen die angestrebte Edelgaskonfiguration. Durch die VB‑Theorie kann bestimmt werden, welche Atome durch eine gemeinsame Reaktion den Edelgaszustand erreichen.
Folgende Abbildung zeigt Beispiele, wie die VB-Theorie auf Moleküle angewendet werden kann. Basis dafür ist die Lewis-Schreibweise. Ein theoretisches Heliummolekül würde die Oktettregel verletzen und ist somit nicht stabil.
Molekülorbitaltheorie
Eine andere Theorie, um zu beschreiben, ob eine chemische Bindung zwischen zwei oder mehreren Atomen möglich ist, ist wie bereits erwähnt die MO-Theorie. Die VB-Theorie geht bei der Bindung von Atomen lediglich von einer Überlappung der Orbitale aus. Das heißt die Elektronen halten sich nach wie vor in ihren ursprünglichen Orbitalen auf.
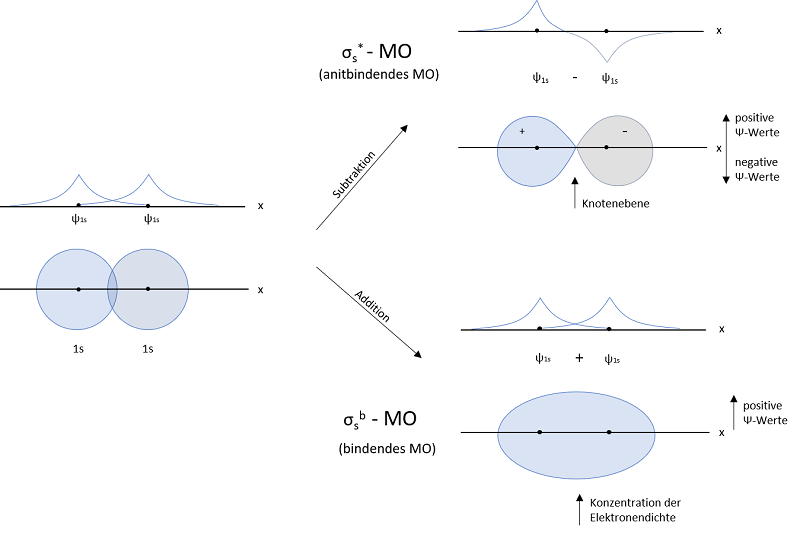
Die MO-Theorie hingegen geht davon aus, dass bei der Reaktion von Atomen ein gemeinsames Molekülorbital gebildet wird. Somit können sich die Valenzelektronen über das gesamte Molekül bewegen. Die entstandenen Molekülorbitale können in der einfachsten Näherung als Linearkombination der Atomorbitale beschrieben werden. Diese Methode, Molekülorbitale aus den Atomorbitalen zu bilden, nennt man linear combination of atomic orbitals kurz LCAO-Näherung.
Diese Methode soll am einfachsten Beispiel, dem Wasserstoffmolekül H2, dargestellt werden. Wasserstoffatome besitzen ein 1s-Atomorbital. Bei der Linearkombination der beiden 1s-Orbitale gibt es zwei Arten, die Wellenfunktionen zu kombinieren.
- Resonanz (Addition)
- Auslöschung (Subtraktion)
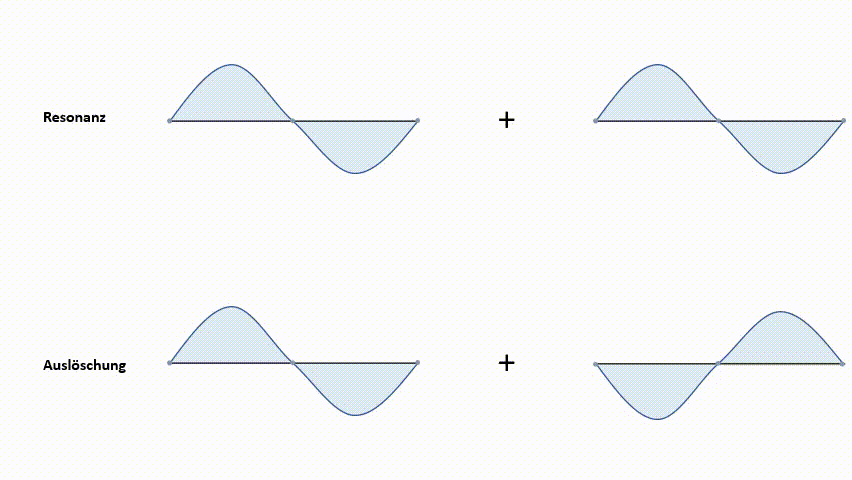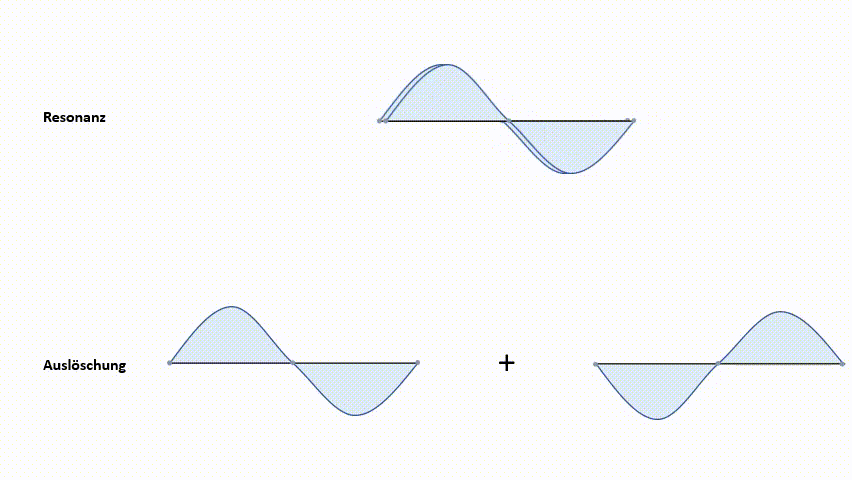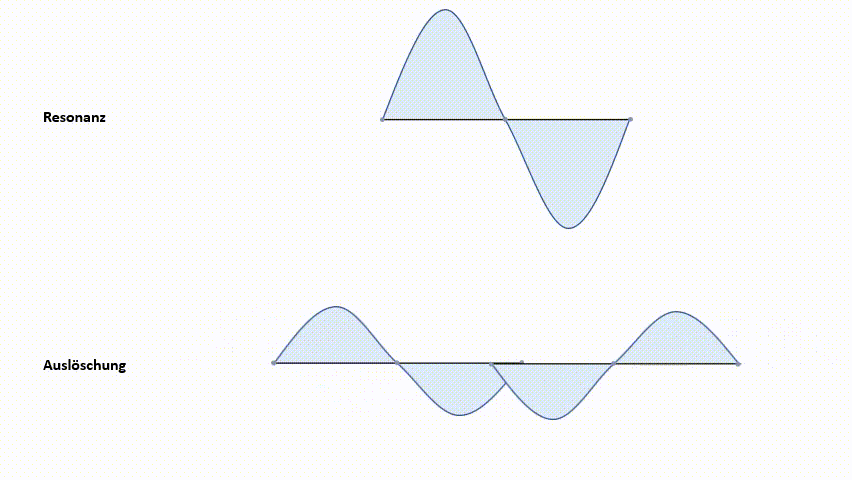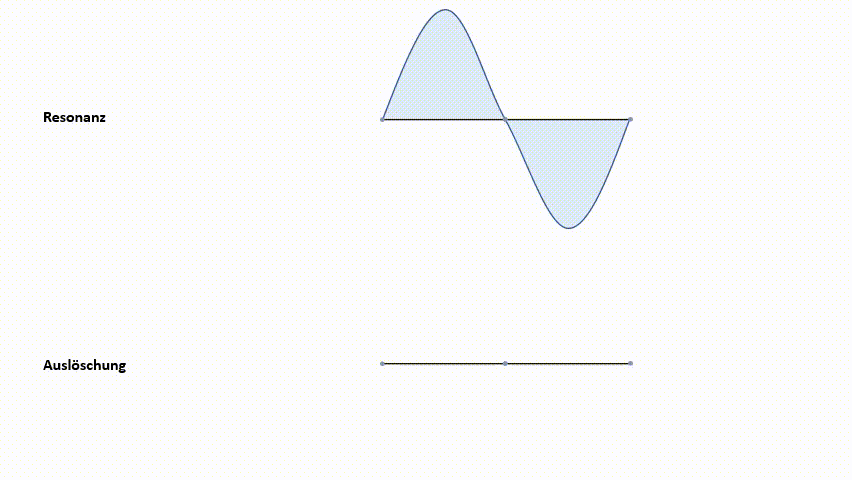
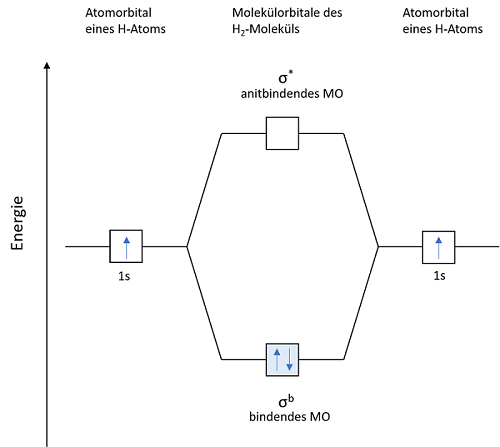
Die erste Möglichkeit, die Wellenfunktionen ψ1s zu kombinieren, ist eine Addition. Diese führt zu einem Molekülorbital, in welchem die Elektronendichte zwischen den Atomkernen konzentriert ist. Aufgrund der negativen Ladungskonzentration zwischen den beiden positiven Kernen kommt es zu einer starken Anziehungskraft. Dieses Molekülorbital nennt man ein bindendes MO (Molekülorbital). Elektronen, die sich in diesem MO aufhalten, haben ein geringeres Energieniveau als in den 1s‑Atomorbitalen. Wie bereits erwähnt, ist das einer der angestrebten Zustände.
Die zweite Möglichkeit der Kombination der Wellenfunktionen ψ1s ist eine Subtraktion. Diese bewirkt eine Knotenebene der Aufenthaltswahrscheinlichkeit zwischen den Kernen. Das heißt, die Wahrscheinlichkeit, dass sich direkt zwischen den Kernen Elektronen befinden geht gegen null. Die positiven Ladungen der Kerne stehen sich gegenüber. Es kommt zur Abstoßung der Kerne. Dieses Molekülorbital nennt man antibindendes MO. Das Energieniveau liegt über dem der 1s-Atomorbitale.
Anhand der Linearkombination der Wellenfunktionen, lässt sich für jedes Molekül ein Energieniveaudiagramm erstellen. Durch die Besetzung dieses mit den Elektronen der Atomorbitale lässt sich abschätzen, ob eine Bindung stabil ist oder nicht. Bei der Besetzung der Molekülorbitale gelten die gleichen Regeln wie bei der Besetzung der Atomorbitale:
- Pauli-Prinzip: Jedes Orbital kann nur mit zwei Elektronen antiparallelen Spins besetzt werden
- Hund`sche Regel: Orbitale mit gleicher Energie werden zuerst nacheinander mit Elektronen gleichen Spins besetzt.
Die untenstehende Abbildung zeigt das Energieniveaudiagramm des Wasserstoffmoleküls H2. Wie in dieser zusehen ist, liegt die Summe der Energien der Elektronen im Molekül tiefer als in den Atomen. Die Bindung ist stabil.
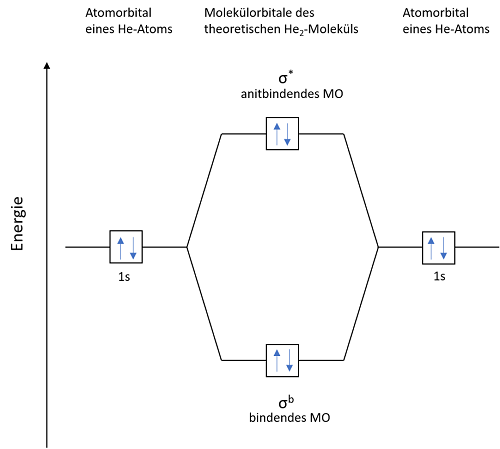
Wie bereits erwähnt liegen Edelgase atomar vor, also ungebunden. Stellt man das Energieniveaudiagramm eines theoretischen He2-Moleküls auf, wird ersichtlich warum. Die Summe der Energien in der Verbindung ist nicht niedriger als in den Atomen.
Energieniveaudiagramme lassen sich auch für komplexere Verbindungen aufstellen. Wobei diese schnell an Übersichtlichkeit verlieren. Zwei weitere Beispiele, vergleichsweise immer noch einfacher Verbindungen, sind in der untenstehenden Grafik, für das Sauerstoffmolekül O2 und das Fluormolekül F2, angeführt.
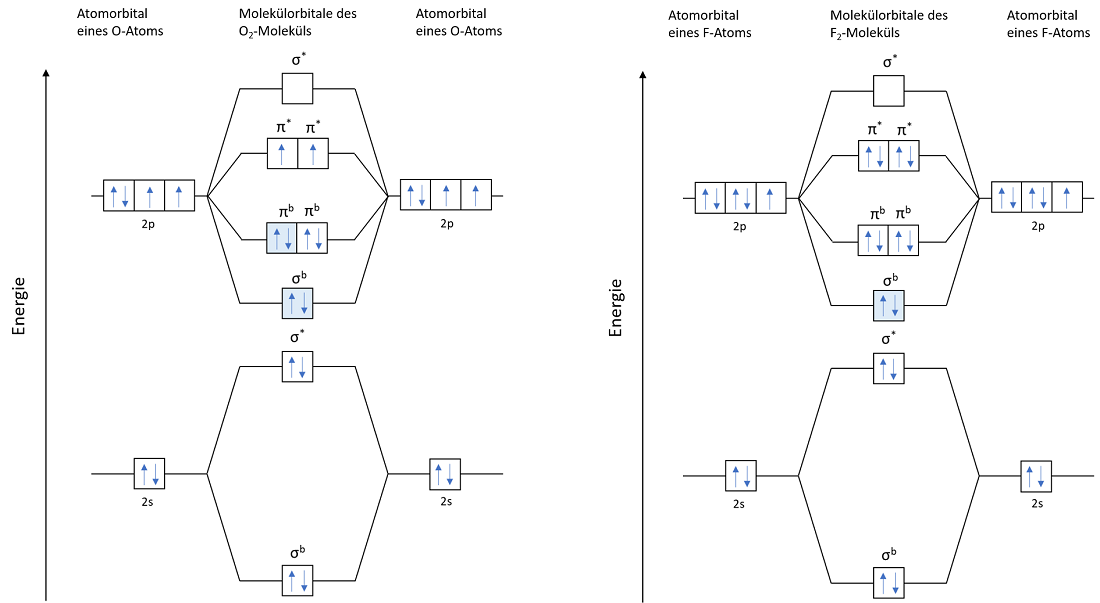
Auch wenn die VB-Theorie und die MO-Theorie mit unterschiedlichem Ansetzen an die Thematik herangehen, konnten dennoch die gleichen Schlüsse über die Stabilität der betrachteten Verbindungen gezogen werden.
Literatur
Hänsel, H., & Neumann, W. (1995). Physik – Atome Atomkerne Elementarteilchen. Berlin: Spektrum.
Hänsel, H., & Neumann, W. (1996). Physik – Moleküle und Festkörper. Berlin: Spektrum.
Huheey, J. E., Keiter, E. A., & Keiter, R. L. (1972). Anorganische Chemie. Prinzipien von Struktur und Reaktivität. (4. Aufl.). Berlin: Institut für Chemie der Technischen Universität Berlin.
Mosca, G., & Tipler, P. A. (1994). Physik für Wissenschaftler und Ingenieure. (7. Aufl.). Berlin: Spektrum.
Riedel, E. (1979). Allgemeine und anorganische Chemie. (10. Aufl.). Berlin: De Gruyter.