Historische Atommodelle
Das Dalton-Modell
Nachdem bis in die Neuzeit keine Entdeckungen gemacht wurden, die in die Größenordnung von Atomen reichte, dauerte es bis 1803, als ein wegbereitendes Atommodell von John Dalton vorgestellt wurde. In seinem Modell gab es so viel verschiedene Atome, wie es Elemente gab. Dazu meinte er:
„Elemente bestehen aus für das jeweilige Element charakteristischen, in sich gleichen und unteilbaren Teilchen, den Atomen“
Im Gegensatz zu den Vorstellungen der griechischen Philosophen unterscheiden sich in seinem Modell die Elemente aber auch durch die Masse und ihr Volumen. Diese Atome können miteinander verbunden und wieder getrennt werden, Atome selbst können jedoch nicht zerstört werden. Bei chemischen Reaktionen ordnen sich demnach die Atome neu an, ändern sich selbst aber nicht. In seinem Modell konnte man allerdings auch noch nicht zwischen einem Atom und einem Molekül unterscheiden.
Dalton versuchte auch eine Ordnung in die Atomgewichte zu bekommen und legte damit einen Grundstein für die spätere Entwicklung des Periodensystems. Auf ihn ist auch Verwendung der Atomaren Masseneinheit (amu oder u) zurückzuführen, die früher mit der Einheit Dalton bezeichnet wurde, und in etwas der Masse eines Wasserstoffatoms entspricht.
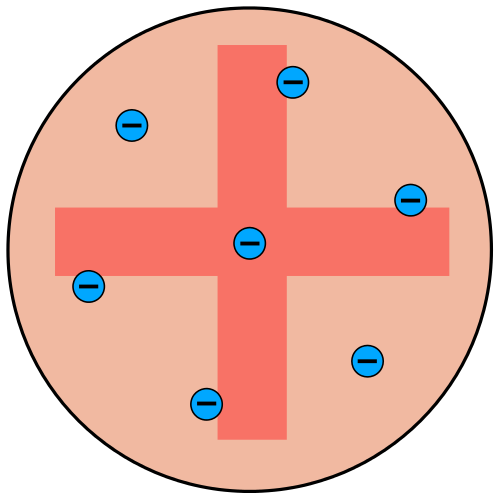
Thomsonsches Atommodell
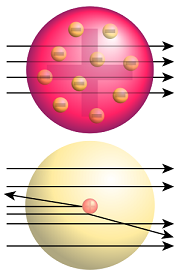
Dieses auch als Rosinenkuchenmodell bekannte Modell wurde 1903 von Joseph Thomson vorgestellt. Wenige Jahre zuvor (1897) wurde als erstes Elementarteilchen überhaupt das Elektron entdeckt und als Bestandteil der Materie ausgemacht. Die angenommene Unteilbarkeit von Atomen war damit Geschichte. Folglich brauchte es ein Atommodell, das die negativ geladenen Elektronen miteinbezieht. In diesem neuen Modell vermutete Thomson die einzelnen Elektronen in einer kontinuierlichen Substanz eingebettet, ähnlich wie die Rosinen im Kuchen verteilt sind. Da das Atom insgesamt elektrisch neutral ist, muss diese Substanz positiv geladen sein und sich mit der Ladung der Elektronen ausgleichen. Thomson vermutete die gesamte Masse des Atoms in den Elektronen konzentriert, wonach der positiv geladene Anteil keine Masse haben sollte. Die Elektronen sind dabei in dieser Masse verteilt und beginnen bei mehr zugeführter Energie zu schwingen.
Bald wurde jedoch bekannt, dass ein Atom gar nicht so viele Elektronen haben kann, dass sich damit die gesamte Masse erklären lässt und man vermutete für Wasserstoff nur ein Elektron. Damit würde aber nur ein Elektron im Wasserstoffatom schwingen. Das Modell erlaubt damit aber nur eine Spektrallinie.
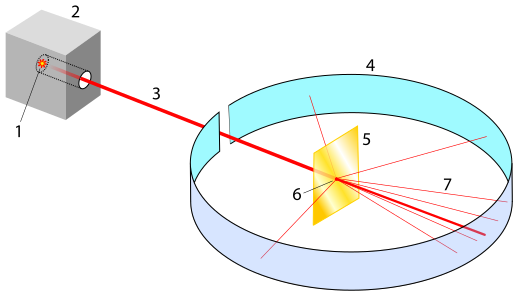
-> Was sind Spektrallinien?
Sendet man Licht auf Atome einer bestimmten Sorte, so kann das Licht entweder durchgehen, reflektiert oder absorbiert werden. Wird das Licht absorbiert, so muss die aufgenommene Energie im Atom eine Veränderung bewirken. Im Thomson-Modell äußert sich das durch Schwingungen der Elektronen. Bestrahlt man also ein Atom mit Licht, so werden nur die Frequenzen des Lichts aufgenommen, die das Elektron anregen können und die Elektronen beginnen zu schwingen. Nun stellt man hinter die bestrahlte Materie einen Schirm, der die ankommende Strahlung registriert. In dem ankommenden Spektrum fehlt damit aber genau das Licht, das von den Atomen absorbiert wurde. Das nennt man Absorptionsspektrum. Ein kontinuierliches Lichtspektrum sieht so aus:

Ein Absorptionsspektrum sieht dann so aus:


- Einem Elektron stehen nicht alle mögliche Bahnen zur Verfügung, sondern nur bestimmte. Auf diesen Bahnen strahlt es keine Energie ab.
- Ein Elektron kann von einer Bahn in eine andere Bahn springen. Ein sogenannter Quantensprung kann dann passieren, wenn die Energiedifferenz der beiden Bahnen absorbiert oder emittiert wird.
Bohr schafft damit eine kontinuierliche Ansicht ab und schafft die Postulate im klaren Widerspruch zur Elektrodynamik.
Das Bohrsche Atommodell kann im Gegensatz zum Modell von Rutherford u.a. Folgendes erklären:
- Die Größe eines Atoms kann richtig abgeschätzt werden.
- Die Spektrallinien des Wasserstoffatoms können nun physikalisch erklärt werden. Die einzelnen fehlenden Linien im Absorptionsspektrum entsprechen der aufgenommenen Energie der Elektronen, die aber nicht zu schwingen beginnen, wie es noch Thomson erklärt hatte, sondern die Energie entspricht einem Quantensprung von einer Bahn auf die andere. Da nur bestimmte Bahnen erlaubt sind, sind auch die Sprünge immer eindeutig in den Spektrallinien zuordenbar.
Der Abstand eines Elektrons zum Kern kann im Bohrschen Atommodell gut abgeschätzt werden. Dazu muss man sich vergegenwärtigen, dass beim Kreisen des Elektrons um den Kern einerseits die Coulombkraft, und andererseits die Zentripetalkraft wirkt. Ein Gleichsetzen der Kräfte ergibt
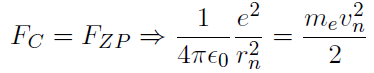
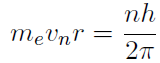
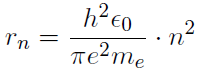
- Damit wird nur ein Elektron des Wasserstoffatoms beschrieben, mehrere Elektronen gleichzeitig werden nicht berechnet.
- Das Atom kreist bei Bohr in einer Ebene und damit flach.
- Chemische Bindungen können mit dem Modell nicht erklärt werden.
- Nicht alle Linien im Wasserstoffatom können exakt erklärt werden.
- Es widerspricht nicht nur der Elektrodynamik, sondern auch weiteren Erkenntnissen der Quantenmechanik (z.B. Unschärferelation).
Aufgrund seiner hohen Anschaulichkeit wird immer noch oft dieses Modell herangezogen, auch wenn es deutliche Schwächen aufweist.