Bindungsarten
Es wurde geklärt wie und warum sich Atome durch Bindungen zu Molekülen zusammenschließen. Dabei ist es wesentlich zu wissen, dass es mehrere Bindungsarten gibt, die sich zwischen den Atomen ausbilden können. Welche Bindungsart, beziehungsweise welche Übergangsform, ausgebildet wird, hängt von den Eigenschaften der jeweiligen Reaktionspartner ab. In diesem Kapitel wird geklärt, welche Bindungsarten es gibt und wodurch diese charakterisiert werden.
Bevor auf die Bindungsarten konkret eingegangen wird, muss noch die dafür entscheidende Größe behandelt werden, die Elektronegativität. Diese Größe ist bestimmend dafür, welche Bindungsart ausgebildet wird. Je größer die Elektronegativität eines Elements ist, desto größer ist dessen Bestreben, Elektronen aufzunehmen. Elemente mit niedriger Elektronegativität bevorzugen es, Elektronen abzugeben.
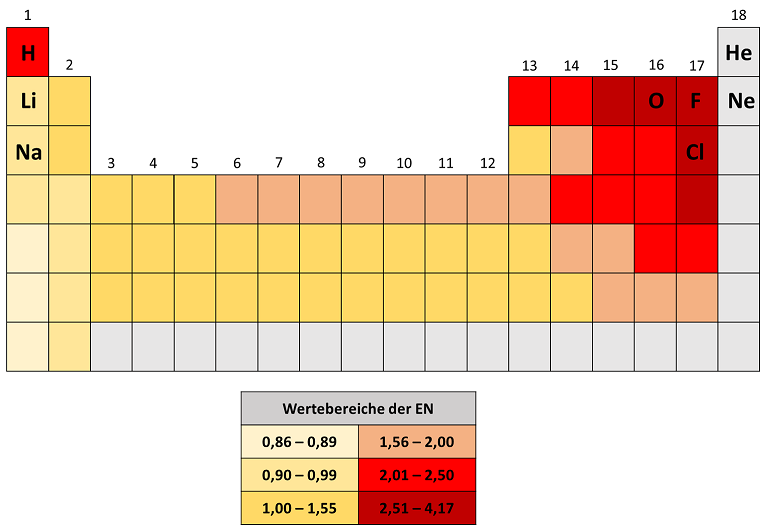
Betrachtet man das Periodensystem der Elemente und lässt man die achte Hauptgruppe, die der Edelgase, außer Acht, gilt folgender Merksatz:
Die Elektronegativität nimmt nach rechts oben zu.
Dieses Verhalten lässt sich gut über die VB-Theorie und die Oktettregel begründen. Dem Element Fluor fehlt ein Elektron, um die Edelgaskonfiguration zu erreichen. Demnach ist sein Bestreben, ein Elektron aufzunehmen deutlich höher als sieben Elektronen abzugeben. Fluor ist das elektronegativste Element.
Auf gleiche Weise lassen sich die Elektronegativitäten der ersten und zweiten Hauptgruppe begründen. Um die Edelgaskonfiguration zu erreichen, muss Natrium ein Elektron abgeben. Die theoretische Alternative dazu wäre, sieben Elektronen aufzunehmen. Das wäre energetisch deutlich ungünstiger und somit nicht möglich. Die restlichen Elemente liegen mit ihren Elektronegativitäten zwischen diesen beiden Extremwerten.
Da die Edelgase den günstigsten Zustand erreicht haben, haben diese kein Bestreben, Elektronen aufzunehmen oder abzugeben. Sie sind chemisch inert.
Folgende Bindungen können sich zwischen Atomen ausbilden:
- Ionenbindung
- Atombindung (kovalente Bindung)
- Metallische Bindung
Zu welcher Bindung es kommt, hängt erstens von der Summe der Elektronegativitäten (Σ EN) der Reaktionspartner ab, zweitens von der Differenz der Elektronegativtäten (Δ EN) der Reaktionspartner.
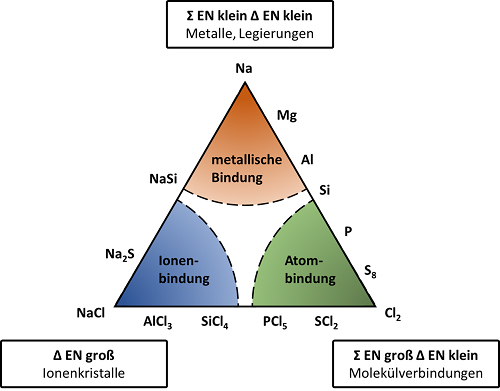
Folgende Grafik veranschaulicht, wie die Reinformen der Bindungsarten ineinander übergehen.
Ionenbindung
Weisen die Reaktionspartner eine große Differenz in der Elektronegativität auf, kommt es zur Ausbildung einer Ionenbindung. Der Reaktionspartner mit der niedrigen EN gibt seine Elektronen an den Reaktionspartner mit der hohen EN ab. Es kommt zur Bildung von Ionen sowie einem Dipol.
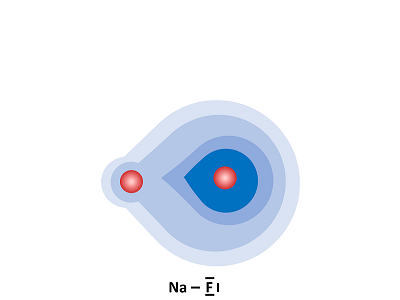
Folgende Grafik soll die Verteilung der Ladungen in der Ionenbindung vereinfacht darstellen.
Der rote Kreis entspricht der positiven Ladung des Kerns. Die blaue Fläche entspricht der Aufenthaltswahrscheinlichkeit der Elektronen. Je dunkler die blaue Färbung, desto größer ist die Aufenthaltswahrscheinlichkeit.
Die Reinform der Ionenbindung bildet sich hauptsächlich zwischen den Elementen der ersten beiden Hauptgruppen sowie der siebten Hauptgruppe aus. Dabei werden aus den Elementen der ersten beiden Hauptgruppen, die positiv geladenen Kationen gebildet, aus den Elementen der siebten Hauptgruppe die negativen Anionen.
Atombindung
Die Atombindung, auch kovalente Bindung genannt, kommt zu Stande, wenn zwei Faktoren erfüllt sind:
- die Differenz der Elektronegativität der Reaktionspartner ist klein bzw. null
- die Summe der Elektronegativitäten ist groß
Der geringe Unterschied in der EN bewirkt, dass keiner der Reaktionspartner, die Elektronen stärker in seine Richtung zieht. Die Ladungsverteilung bleibt homogen.
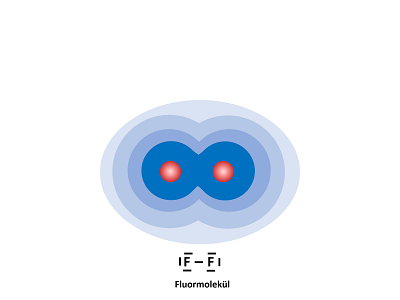
Folgende Grafik soll die Verteilung der Ladungen in der Atombindung vereinfacht darstellen.
Der rote Kreis entspricht der positiven Ladung des Kerns. Die blaue Fläche entspricht der Aufenthaltswahrscheinlichkeit der Elektronen. Je dunkler die blaue Färbung, desto größer ist die Aufenthaltswahrscheinlichkeit.
Die Reinform der kovalenten Bindung bildet sich, wenn Elemente der ersten beiden Perioden mit sich selbst reagieren.
Metallische Bindung
Die metallische Bindung kommt zu Stande, wenn die zwei folgenden Faktoren erfüllt sind:
- die Differenz der Elektronegativität der Reaktionspartner ist klein bzw. null
- die Summe der Elektronegativitäten ist klein
Ähnlich wie bei der Atombindung, bewirkt der geringe Unterschied in der EN, dass die Verteilung der Elektronen homogen bleibt. Ein wesentlicher Unterschied liegt jedoch in der Freiheit der Elektronen. Während die Elektronen in der kovalenten Bindung an die Aufenthaltswahrscheinlichkeit der Molekülorbitale gebunden sind, sind die Elektronen im Metallgitter frei beweglich. Man spricht von der Elektronenwolke. Das ist auch die Ursache, weshalb Metalle gute elektrische Leiter sind.
Die untenstehende Tabelle gibt einen Überblick, über die drei angeführten Bindungsarten und deren charakteristische Eigenschaften.
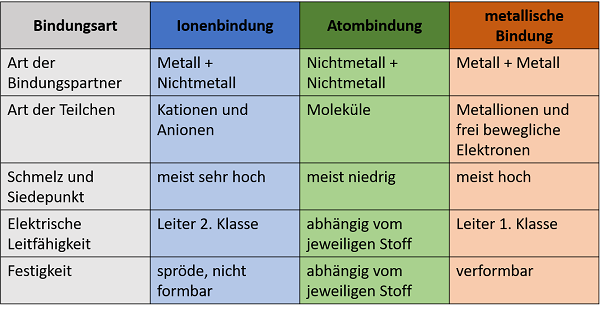
Bisher wurde von den Reinformen der Bindungsarten gesprochen. Das heißt von Verbindungen, welche die genannten Faktoren zum größten Teil bzw. vollständig erfüllen. Jedoch gehen die Bildungsarten fließend ineinander über, wie der oberen Grafik entnommen werden kann.
Die Eigenschaften des Siliciumkristalls, eines Halbleiters, liegen zwischen denen der metallischen und kovalenten Bindung.
Literatur
Hänsel, H., & Neumann, W. (1995). Physik – Atome Atomkerne Elementarteilchen. Berlin: Spektrum.
Hänsel, H., & Neumann, W. (1996). Physik – Moleküle und Festkörper. Berlin: Spektrum.
Huheey, J. E., Keiter, E. A., & Keiter, R. L. (1972). Anorganische Chemie. Prinzipien von Struktur und Reaktivität. (4. Aufl.). Berlin: Institut für Chemie der Technischen Universität Berlin.
Mosca, G., & Tipler, P. A. (1994). Physik für Wissenschaftler und Ingenieure. (7. Aufl.). Berlin: Spektrum.
Riedel, E. (1979). Allgemeine und anorganische Chemie. (10. Aufl.). Berlin: De Gruyter.